- 政策解读
- UDI合规性解读
- 中宝解决方案
- 中宝优势
- 联系方式
习近平总书记指出,医疗器械安全是重大的民生和公共安全问题,提出“四个最严” 要求,加强对医疗器械的全过程监管,着力防范系统性、区域性风险;
药监部门需求: 有效控制风险 不良事件监测、评价与预警 督促企业精准召回;
卫生部门需求: 对医疗器械的准确识别 减少医疗失误、提高服务效率 规范医疗行为;
生产企业: 产品信息化追溯、不良事件监测、精准召回、有效的供应链管理物流管控、产品再评价,强化品牌保护计划;
流通机构: 产品精准识别、进销存信息化管理;
使用机构: 产品识别、采购管理、器械使用管理、结算管理、与患者绑定用于临床评价;
患者: 产品识别、明白消费、保护消费者权益;

国家政策层面
| 国务院办公厅 | 关于加快推进重要产品追溯体系建设的意见 | 推进食品、药品追溯体系建设。药品:推进药品全品种、全过程追溯,建设完善药品追溯体系。 |
| 国务院 | “十三五”国家药品安全规划 | 制定医疗器械编码规则,构建医疗器械编码体系。 |
| 国务院办公厅 | 深化医药卫生体制改革2019年工作重点 | 制定医疗器械唯一标识系统规则,探索实施高值医用耗材注册、 采购、使用等环节规范编码的衔接应用 |
| 国务院办公厅 | 治理高值医用耗材的改革 方案(中央深改委第八次会议) | 制定发布《医疗器械唯一标识系统规则》 |
国际层面
| IMDRF | 2012年成立UDI工作组,2013年发布IMDRF UDI 指南; 2017年UDI应用指南工作组,围绕实施层面的开展国际协调,2019年3月批准发布, 包括一个技术文件和两个信息文件。 |
| AHWP/td> | UDI工作组,2019年研究制定AHWP UDI白皮书。 |
| 美国FDA | 2013年发布UDI规则,2014年第一批产品实施,目前二类以上产品实施UDI。 |
| 欧盟 | 2017年发布医疗器械和IVD法规,对UDI进行规定。成立医疗器械协调工作组,建立 涵盖上市前后EUDAMED数据库,包含UDI模块。 |
| 日本 | 2008年厚生省发布通知(医政经发第0328001号)要求医疗器械产品的条形码显示。 |
| 韩国 | 已发布UDI法规,2019年第一批开始实施。 |
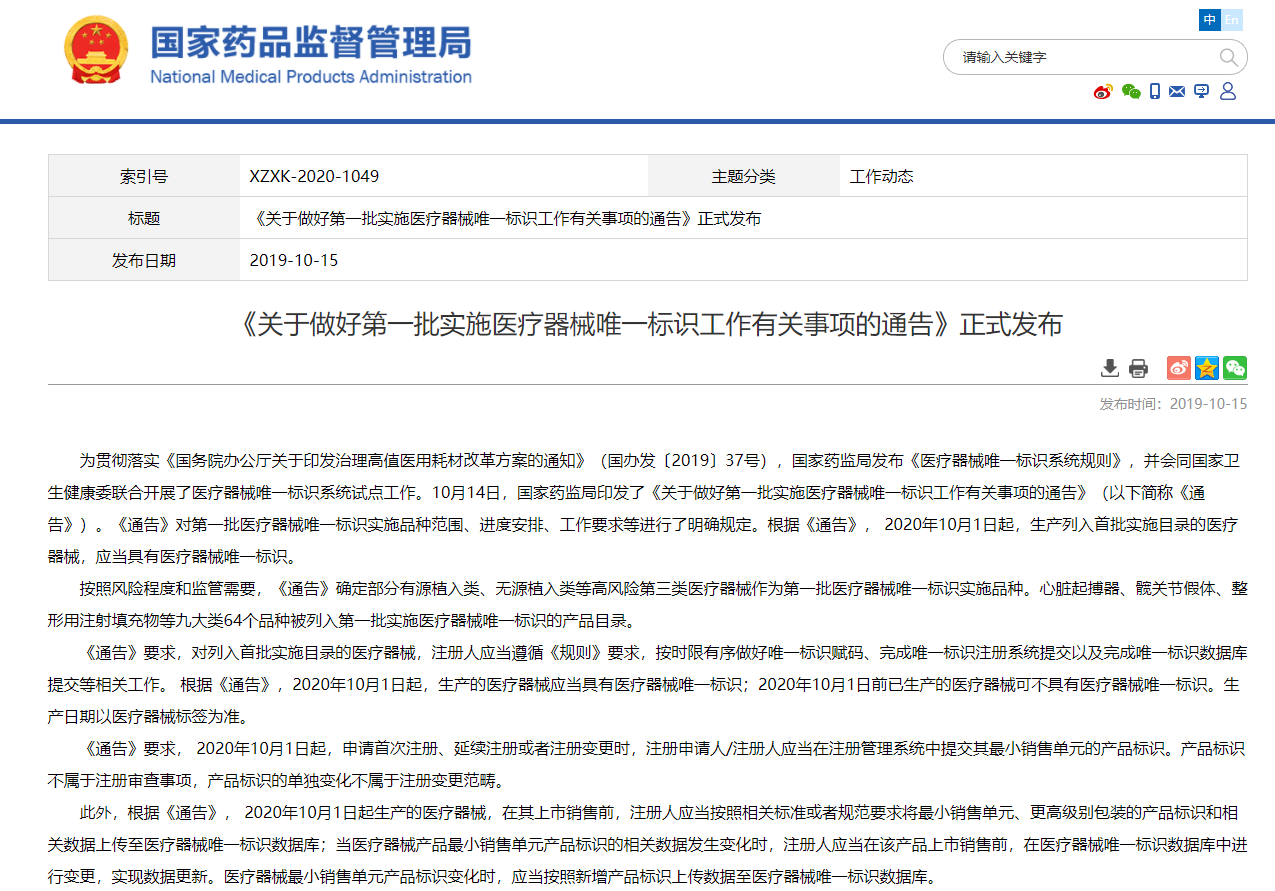
第一批9大类64个品种实施唯一标识(UDI)的医疗器械注册人于2021年1月1日在全国各地已完成。新的《医疗器械监督管理条例》也将在2021年6月1号实施,其中关于UDI也有相关要求,为了确保器械产品能够合规流通,一张合规的UDI标签必不可少。下面一个简单介绍让您对实现UDI合规的流程有一个整体认识。
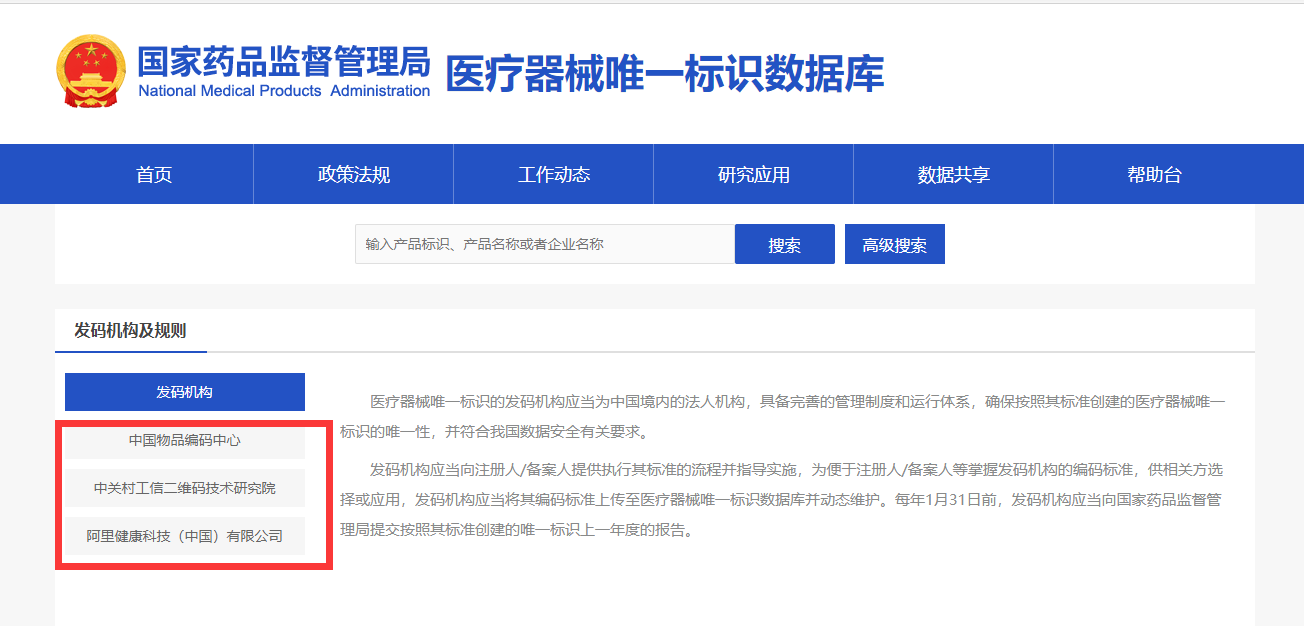
第一步:申请厂商识别码(可选择中国物品编码中心,中关村工信二维码研究机构,阿里健康科技(中国)有限公司等)

第二步:根据国家标准配备产品标识(DI)及生产标识(PI)
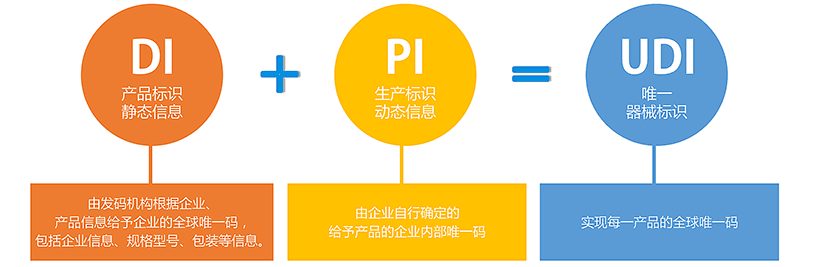
UDI定义
UDI(Unique Device Identification)医疗器械唯一标识,是一种在医疗器械产品或者包装上附载的,由数字、字母或者符号组 成的代码,用以对医疗器械进行唯一性识别。
UDI系统组成
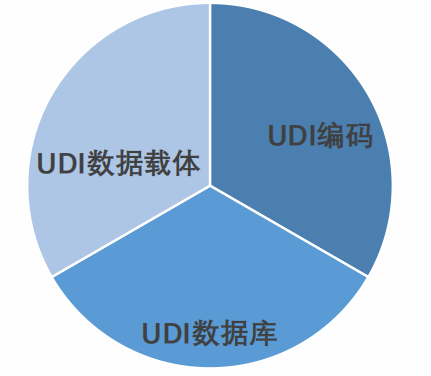
UDI编码 = DI + PI
器械标识(静态信息) -企业 -产品ID
产品标识(动态信息) -生产批号 -序列号 -生产日期 -有效 期 -失效日期 -校验位
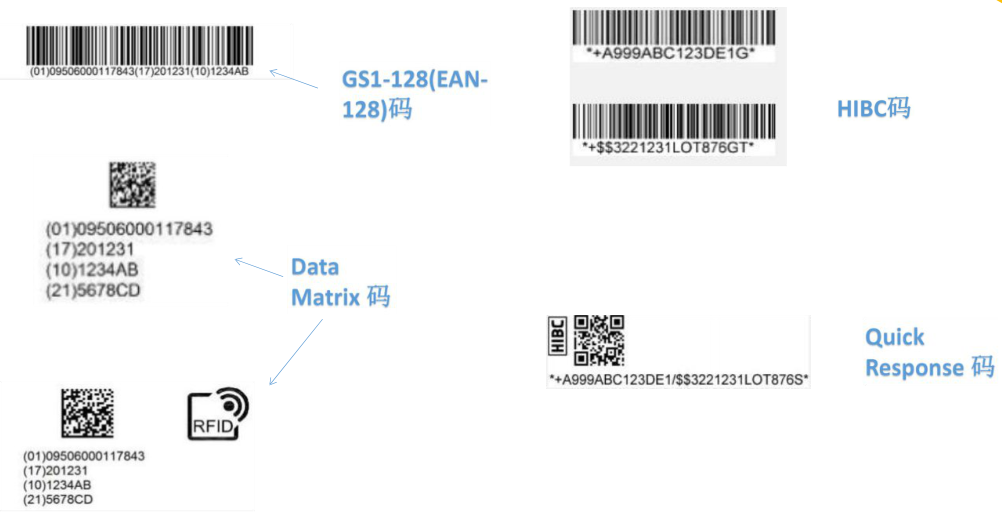
第三步:设计及打印UDI一维、二维条码或RFID标签

第四步:将标签贴于医疗器械产品或者包装上,并上传国家药监局数据库平台
中宝赋码方案
中宝科技一直致力于医药行业,力求为医药及医疗器械企业提供相关完整的解决方案,在医疗器械UDI方面以医疗器械企业实际情况出发,为客户提供各种符合企业实际需求的方案,具体如下:
方案一:人工模式
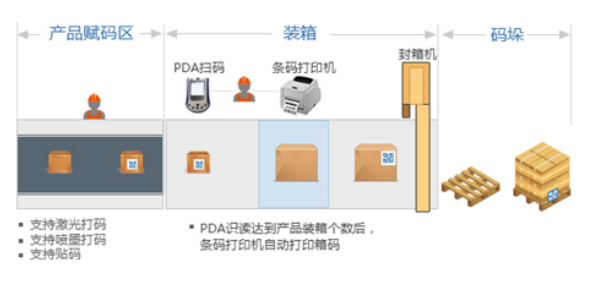
方案二:半自动方案
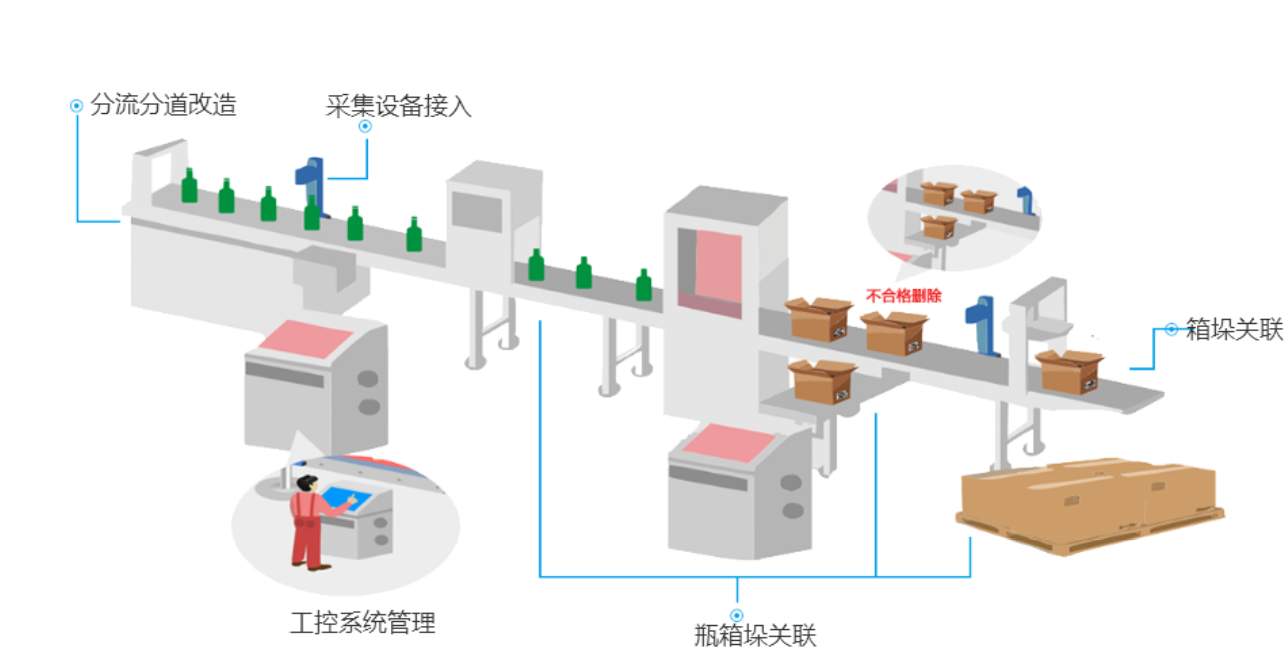
集成解决能力



系统可扩充性
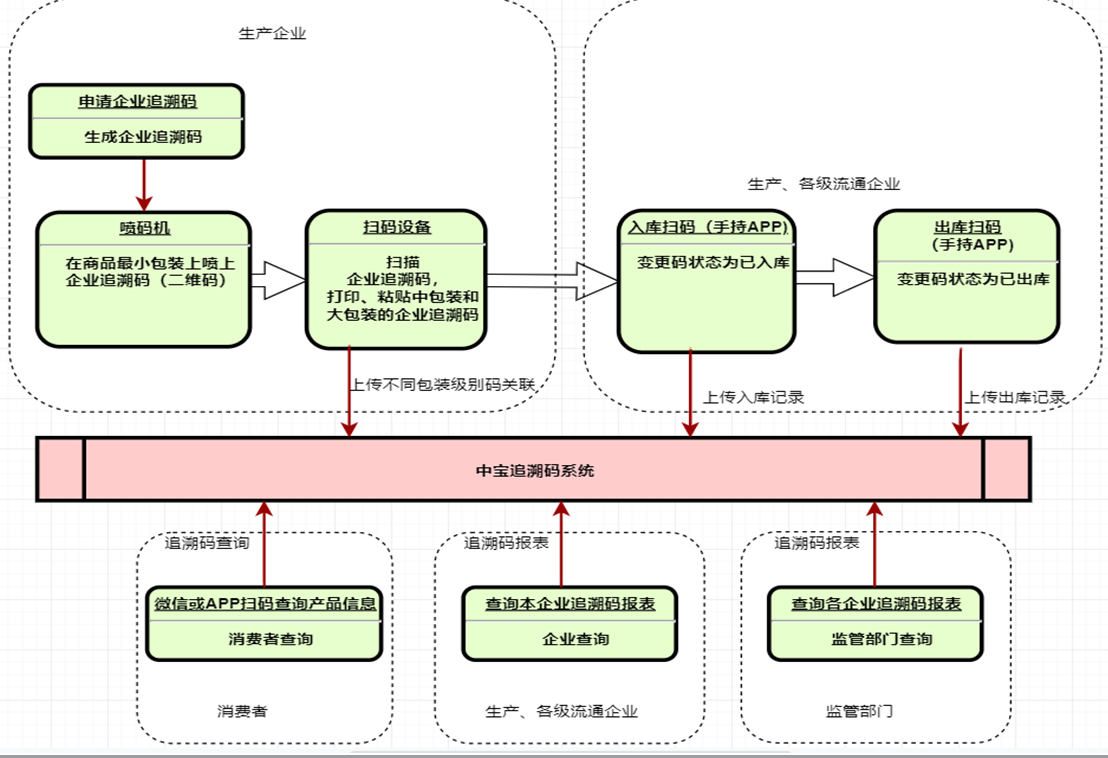
在赋码基础上可叠加二维码做后续营销服务:未来以防伪溯源为主要功能的二维码标签,也可以开发和消费者互动的活动,包括红包活动、积分、优惠劵、抽奖、分享等等,以活动提高扫码的积极性,增加客户黏性,同时邀请用户注册,使消费者长期消费。
1、提供免费的软件。
2、极力缩短实施周期,最快在几小时内完成,60%以上企业在一天内完成系统实施。
3、最大限度减小切换的成本,减低系统上线对企业正常作业的影响。
4、系统稳定,提供7*24小时的服务,保障系统安全稳定运行。
整体做到简单、改造成本低、设备要求门槛低、操作简便易上手。


公司地址:杭州市西湖区文一西路588号西溪首座A2-1,5楼
联系方式:0571-28927715